3次元細胞培養容器「ミコセル®」を用いた 変形性膝関節症に対する臨床研究(安全性確認)を終了 -共同研究先クリニックで細胞凝集塊の安全性を確認-
- 研究開発
株式会社日本触媒(本社:大阪市中央区、社長:五嶋祐治朗、以下「日本触媒」)と医療法人再生会そばじまクリニック(所在地:大阪府東大阪市、院長:傍島 聰、以下「「そばじまクリニック」)は、日本触媒が開発した3次元細胞培養容器「ミコセル®」で作製した脂肪由来幹細胞凝集塊の変形性膝関節症※に対する臨床研究(安全性確認)を2021年2月より開始し、このたび終了しました。この臨床研究により、そばじまクリニックにおいて上記の細胞凝集塊の安全性が確認されました。
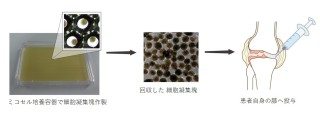
ミコセルは、日本触媒が独自技術により開発した3次元細胞培養容器で、粒子径が揃い生体内での状態に近い細胞凝集塊を多量に作製できることを特徴とします。日本触媒とそばじまクリニックは、ミコセルを用いたヒト脂肪由来幹細胞凝集塊の変形性膝関節症に対する安全性、および有効性のデータ取得を目的とした臨床研究を実現するため共同研究を実施してまいりました。本臨床研究は、被験者自身の脂肪由来幹細胞をミコセルで細胞凝集塊とし、これを膝関節内に注射投与を行うものです。本臨床研究(安全性確認)は、そばじまクリニックが「再生医療等の安全性の確保等に関する法律」において求められる「第2種再生医療等計画」を再生医療等委員会へ申請して承認され、2020年12月18日に近畿厚生局に受理後、開始され、2022年2月28日に終了報告を行っております。
本臨床研究の詳細は、臨床研究データベース「Japan Registry of Clinical Trials ( https://jrct.niph.go.jp/ )」にて臨床研究実施計画番号:jRCTb050200097をご参照ください。
今回のそばじまクリニックにおける臨床研究では、ミコセルを用いて作製した細胞凝集塊を計5名の被験者へ投与して、細胞凝集塊の安全性を確認しました。この臨床研究の詳細は、3月17日から開催を予定している第21回日本再生医療学会総会にて傍島院長が発表します。
発表学会:第21回日本再生医療学会総会(オンライン開催)
演題名:変形性膝関節症に対する皮下脂肪組織由来幹細胞凝集塊移植の安全性に関する臨床研究報告
発表者:医療法人再生会 そばじまクリニック 院長 傍島 聰
セッション名: 一般口演 20「間葉系幹細胞・体性幹細胞4」
セッション日時:2022年3月19日(土)13:20~14:20
今後は、有効性の確認を行うため、臨床研究(有効性確認)の承認申請並びに実施を進めていく予定です。
本臨床研究により、細胞凝集塊を用いた治療の実用化ならびに再生医療の更なる発展に向けて貢献してまいります。
※変形性膝関節症(OA)は、膝の軟骨がすり減ったり、失ったりしたために膝の形が変形し、痛みや腫れをきたす疾患を指します。国内患者数は約1000万人、自覚症状はないがX線診断により症状が確認される潜在患者数は更に約3300万人いるといわれている病気で、主な原因は加齢によるものであり、高齢化の中、患者数は年々増加しています(厚生労働省老健局介護予防の推進に向けた運動器疾患対策に関する検討会 「介護予防の推進に向けた運動器疾患対策について報告書 平成20年7月1日」より)。
以上
日本触媒について:
1941年の創業以来、自社開発の触媒技術を核に事業を拡大。酸化エチレンやアクリル酸、自動車用・工業用触媒などを世の中に送り出し、現在では紙おむつに使われる高吸水性樹脂で世界1位のシェアを誇っています(当社調べ)。日本触媒は「テクノロジー(技術)」を通じて「アメニティ(豊かさ)」を提供する、という企業理念「TechnoAmenity」のもと、グローバルに活動する化学会社です。
https://www.shokubai.co.jp
【問い合わせ先】
株式会社日本触媒 コーポレート・コミュニケーション部
TEL:03-3506-7605 〒100-0011 東京都千代田区内幸町1-2-2
E-mail: shokubai@n.shokubai.co.jp
【関連ファイル】
・3次元細胞培養容器「ミコセル」を用いた 変形性膝関節症に対する臨床研究(安全性確認)を終了 -共同研究先クリニックで細胞凝集塊の安全性を確認-